Healthy Microbiome is Essential to Optimize Health
TNO develops better research tools that enable the development of Microbiome-Directed Health Products.
Application areas are,
I-Screen system; ヒト腸内細菌叢(小腸、および大腸由来)による代謝物解析
医薬品の腸内細菌による代謝は、薬物の有効性や副作用に影響を与える重要な要因の一つです。
腸内細菌は、薬物を代謝して異なる化合物に変換することがあり、これが薬物の体内動態や作用機序に影響を与える可能性があります。以下は、この問題に関連するいくつかのポイントです。
1. プロドラッグの活性化: 一部の薬物は、腸内で特定の細菌によって活性化される「プロドラッグ」として設計されています。これらの薬物は、体内で効果的な薬物に変換される前に、腸内で特定の細菌によって変換される必要があります。
2. 腸内細菌の多様性:人々の腸内細菌叢は個人差があり、異なる細菌の種類と量が異なります。この多様性が、同じ薬物を摂取しても個々の患者で異なる薬物代謝プロファイルを生み出す可能性があります。
3. 副産物の生成: 腸内細菌が薬物を代謝する過程で、異なる代謝産物が生成されることがあります。これらの副産物が予測できない副作用を引き起こす可能性があります。
4. 薬物の吸収:腸内での薬物代謝が速やかに行われる場合、薬物の吸収が影響を受け、有効な濃度が達成されにくくなる可能性があります。
5. 個人差: 同じ薬物を摂取しても、個々の患者で腸内細菌の種類や量が異なるため、薬物応答には個人差が現れることがあります。
6. 原薬のBCSクラス分類(Class I~IV):ここ数年、新しく開発された医薬品は溶解性や浸透性が低いという特徴を持ち、BCS分類のClass II または III または IV の医薬品に属する傾向があります。
この傾向は主に、新たに設計された薬剤の構造の複雑さの増加によって引き起こされており、 その結果、これら薬剤の溶解性と吸収性が損なわれ、経口投与後の胃腸管内での滞留時間が長くなり、結腸内の薬剤濃度が高くなります。
また、経口投与された薬剤だけが結腸に到達するだけでなく、静脈内投与(IV)された薬剤も、肝臓のグルクロン酸抱合後など、胆汁排泄を介して小腸、および結腸に到達する可能性があります。
これらの要因は、個々の患者に対する適切な治療法の選択や、薬物の効果や安全性の評価に影響を与える可能性があります。
したがって、個別の患者に合わせた医薬品治療の開発や、腸内細菌の影響を考慮した薬物デザインが将来的な医療の方向性となる可能性があります。
I-screenはヒト腸内細菌叢を再現したin vitro screening platform です。ヒト腸内細菌叢は、ヒトのインビボ代謝を模倣する目的でマルチウェルシステム上で嫌気条件で培養され、候補医薬品のヒト腸内細菌叢による代謝物を高精度に解析することを可能にします。健常者、あるいは疾患(例えば肥満)、痩せ型の成人、あるいは子供、高齢者等から収集したヒト腸内細菌叢の選択が可能です。
Animation of targeted identification of compounds to restore a balanced microbiome.
I-screenは、様々な異なる条件を同時に再現し、複数の化合物、および複数の濃度を一度にテストできます。 例えば、バランスの取れた微生物叢を復元するための候補化合物スクリーニングに利用することも可能です。
またTNOの微生物研究における専門知識を活用し広範な毒性試験・分析を実施することが可能です。様々な技術とプラットフォーム、例:Ex vivo InTESTine model とI-screen の組み合わせで微生物叢と宿主間の相互作用、および特定の微生物叢が人体に毒性を及ぼす程度を評価することが可能となります。
I-Screenを使用するベネフィット・測定項目
 I-Screenは、ヒト腸内細菌叢(小腸、および大腸由来)による代謝を受けやすい薬品の迅速なスクリーニングを可能にします。 さらに腸内細菌叢によって変換された未知代謝物を同定するために使用することができます。
通常、ヒト固有の代謝物プロファイリング、および同定は、臨床試験フェーズIIまたはIIIの間に実施されますが、I-screenを使用することでヒト固有代謝物を前臨床段階で同定することができます。
医薬品開発プロセスのリスク軽減を加速させることを可能とする費用対効果の高い候補薬スクリーニングシステムといえます。
I-Screenは、ヒト腸内細菌叢(小腸、および大腸由来)による代謝を受けやすい薬品の迅速なスクリーニングを可能にします。 さらに腸内細菌叢によって変換された未知代謝物を同定するために使用することができます。
通常、ヒト固有の代謝物プロファイリング、および同定は、臨床試験フェーズIIまたはIIIの間に実施されますが、I-screenを使用することでヒト固有代謝物を前臨床段階で同定することができます。
医薬品開発プロセスのリスク軽減を加速させることを可能とする費用対効果の高い候補薬スクリーニングシステムといえます。
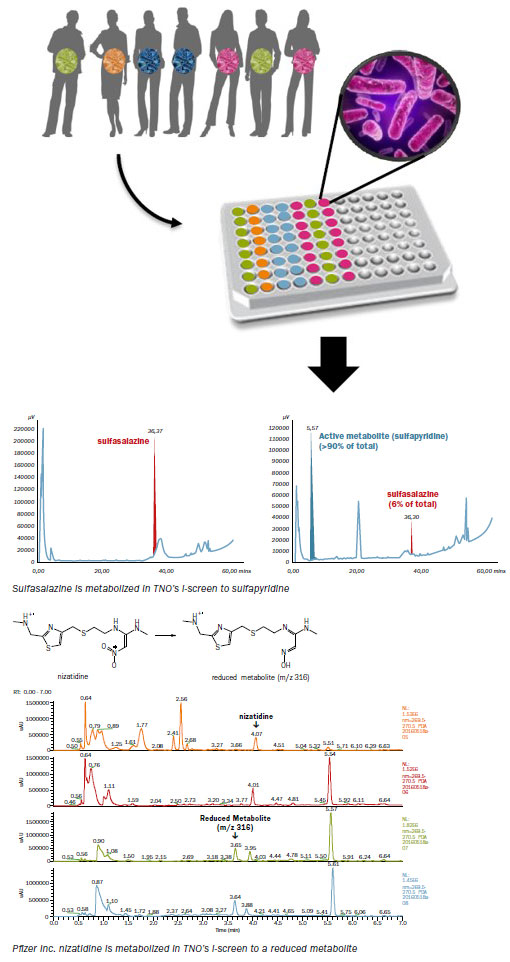
例1: 腸内細菌叢によるスルファサラジンの代謝; スルファサラジンは、ヒトの腸内微生物叢によって治療効果のある 5-アミノサリチル酸に代謝されるプロドラッグとして設計されています。
しかし、臨床研究では、スルファサラジンは主に腸内細菌によってスルファピリジンに代謝され、それが副作用を引き起こすことが報告されています。
この例では、健康な成人の微生物叢を 100 μM スルファサラジンに曝露しました。 サンプルは0時間後と24時間後に採取され、HPLCにより分析しました。
例2: 腸内微生物叢によるニザチジンの代謝; ヒト腸内微生物叢によって代謝されることが知られている医薬品のニザチジンの評価にI-screenを使用しました。
インキュベーション後、サンプル分析はHigh Resolution Mass Spectrometryを用いてファイザー社により実施されました。
健康な成人の微生物叢を50μMニザチジンに曝露し、0、6、24および48時間後に採取したサンプルは腸内細菌叢の代謝能力を明確に実証しました。
その他、測定可能な項目・利用可能なテクノロジー
● Microbiome composition
> 16S or metagenome
> ITS Fungal composition
> Anti-biotic resistance
> Viability
● Microbiome Function
> Transcriptome
> Metabolome
> SCFA analysis
> Microbiome metabolites
> Drug metabolites
> Microscopy (fluorescence)
● Physiology of Host
> Blood biomarkers
> Metabolites
> Host-microbiome
> Interactions
I-screen ウェビナー情報
2021年11月9日に開催されたI-screen, Ex vivo InTESTine の最新の研究成果に関するウェビナー・パネルディスカッション「In vitro microbiome and ex vivo intestinal models」を下記 Link より on demand にてご視聴いただけます。
ご視聴にはメールアドレス等の登録が必要です。(所要時間:約50分 動画推奨ブラウザ: Google Chrome)
Program: You can watch this webinar on demand via this link:
発表論文
Drug Metabolism and Disposition, March 2024
Gut Microbiome Integration in Drug Discovery and Development of Small Molecules
Patrick Jimonet, Celine Druart, Stephanie Blanquet-Diot, Lilia Boucinha, Stephanie Kourula, Francoise Le Vacon, Sylvie Maubant, Sylvie Rabot, Tom Van de Wiele, Frank Schuren, Vincent Thomas, Bernard Walther, Michael Zimmermann; Medicen Microbiome Drug Metabolism Working Group
Microbiome Research Report 2024
A host-microbial metabolite interaction gut-on-a-chip model of the adult human intestine demonstrates beneficial effects upon inulin treatment of gut microbiome
Joanne M. Donkers, Maria Wiese, Tim J. van den Broek, Esmee Wierenga, Valeria Agamennone, Frank Schuren and Evita van de Steeg.
Drug Metabolism and Disposition August 29, 2018,
An ex vivo fermentation screening platform to study drug metabolism by human gut microbiota
Evita van de Steeg, Frank H.J. Schuren, R. Scott Obach, Claire van Woudenbergh, Gregory S. Walker, Margreet Heerikhuisen, Irene H.G. Nooijen and Wouter H.J. Vaes
BMC Med Genomics. June 2014
A systems biology approach to understand the pathophysiological mechanisms of cardiac pathological hypertrophy associated with rosiglitazone.
Verschuren L, Radonjic M, Wielinga PY, Kelder T, Kooistra T, van Ommen B, Kleemann R.
Best Pract Res Clin Gastroenterol. Feb 2013.
Ex vivo systems to study host-microbiota interactions in the gastrointestinal tract.
Roeselers G, Ponomarenko M, Lukovac S, Wortelboer HM
PLoS One. Feb 2013
Differential effects of drug interventions and dietary lifestyle in developing type 2 diabetes and complications: a systems biology analysis in LDLr-/- mice.
Radonjic M, Wielinga PY, Wopereis S, Kelder T, Goelela VS, Verschuren L, Toet K, van Duyvenvoorde W, van der Werff van der Vat B, Stroeve JH, Cnubben N, Kooistra T, van Ommen B, Kleemann R.
Pharmacol Res. Dec 2012.
The human gastrointestinal microbiota--an unexplored frontier for pharmaceutical
Roeselers G, Bouwman J, Venema K,Montijn R.
Pharmacogenet Genomics. Dec 2012.
Systems biology analysis unravels the complementary action of combined rosuvastatin and ezetimibe therapy
Verschuren L, Radonjic M, Wielinga PY, Kelder T, Kooistra T, van Ommen B, Kleemann R.
技術資料・ポスター ダウンロード
● TNO I-Screen (Brochure EN)
●I-Screen: An Ex Vivo Human Microbiome Platform to study Microbiome Induced Reverse Metabolism of Metabolites Back to Parent.(Poster at ISSX-2019)
● In vitro platform to study human gut microbiota induced drug metabolism and molecular transformations (Poster)
●The role of fungi in irritable bowel syndrome (IBS): new insights in human disease development(Poster)
●2021年11月9日に開催されたI-screen, Ex vivo InTESTine の最新の研究成果に関するウェビナー・パネルディスカッション「In vitro microbiome and ex vivo intestinal models」を下記Linkよりご視聴いただけます。
ご視聴にはメールアドレス等の登録が必要です。(動画推奨ブラウザ: Google Chrome)
□ You can watch this webinar on demand via this link:

