HUMAN MODEL TO STUDY INTESTINAL ABSORPTION AND GUT WALL PROCESS
AVAILABLE AS CONTRACT SERVICE, ALSO FOR PARTNERING
Ex vivo 新鮮腸管組織モデル InTESTine
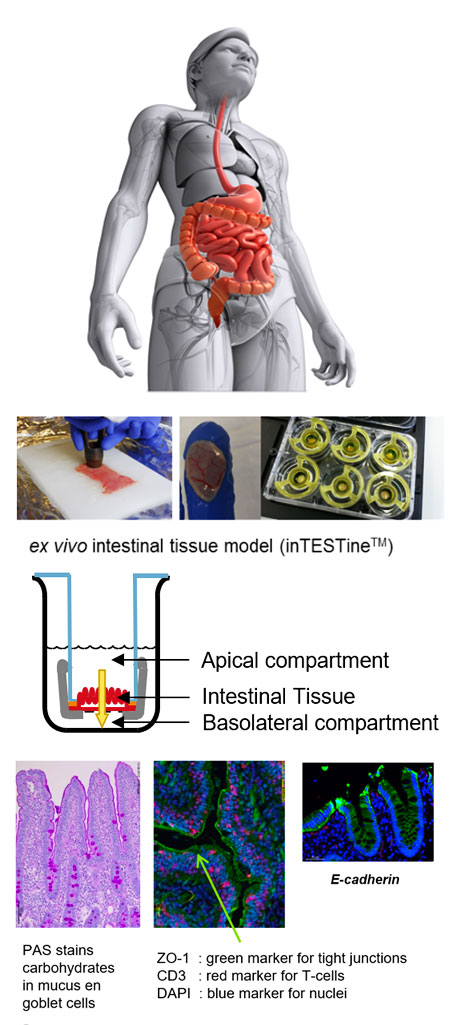
"InTESTine"は薬剤や栄養素等の吸収・透過性・代謝・トランスポーター・炎症反応・初期の腸免疫応答等を研究する目的で開発された腸管セグメントの体外培養系です。
ユニークな点として、薬剤や栄養素の吸収の部位差を検証するために管理された条件下で複数の腸管部位(十二指腸、空腸、回腸、および結腸)を並行して培養することが可能です。
粘液層の厚さ、絨毛の長さ、タイトジャンクションの孔径、トランスポーター、受容体、代謝酵素等の発現レベル等の腸管の性質・機能は十二指腸~結腸間で変化するのでこれらの点を検証できることは極めて有用です。
さらに粘液層が存在するため、微生物叢が存在する状態、または存在しない状態で、消化過程に暴露された後の腸管内で起きている事象・過程を検証することも可能です。
用途
● 医薬品;低分子、Peptide, Protein、新規モダリティ(PROTAC)、栄養素等の腸管での吸収・代謝検討
● トランスポーター, 代謝活性(CYP3A4), 医薬品-食品間の相互作用, 賦形剤のAPIへの影響等の検証
● 粘液層との相互作用、バリア機能への影響、保護作用等の検証
● 腸管部位ごとの吸収・透過性比較
● 医薬品や栄養素の消化管ホルモン分泌に与える影響の検証(腸内分泌L細胞が存在)
> Satiety hormones (GLP-1, PYY, GIP, CCK, GLP-2), Serotonin, Melatonin.
● ペプチドの粘液吸着
● 腸管におけるアレルゲン輸送経路の解明・好塩基球活性
● Host-microbe interactions exposure to pathogens
Read-out: Local Immunoresponse (Cytokine, Prostaglandins, etc)
Transcriptomics, Proteomics, Bacterial translation (Pre,Pro-biotics,etc)
ご利用可能な組織サンプル
● ヒト組織の場合:回腸、結腸(various disease groups, e.g. IBD, colon cancer)、Organoid, Enteroid(various age groups)
● ブタ組織の場合:十二指腸、空腸、回腸、結腸
● イヌ、およびラット組織の使用も可能
ご利用可能な検出法
● ELISA, Luminex, Fluorescence, FACS, RNAseq, Radiolabels, RT-PCR, qPCR, HPLC/UPLC, LCMS/MS, AMS
技術資料ダウンロード:
●
InTESTine (Brochure EN)
● Advancing Drug Research with the InTESTineTM Platform: Ex Vivo Intestinal explant Applications for Peptides and Permeability Enhancers. (Poster at the 41th JSSX 2025)
Gut-on-a-Chip, Host-Microbial Interaction model
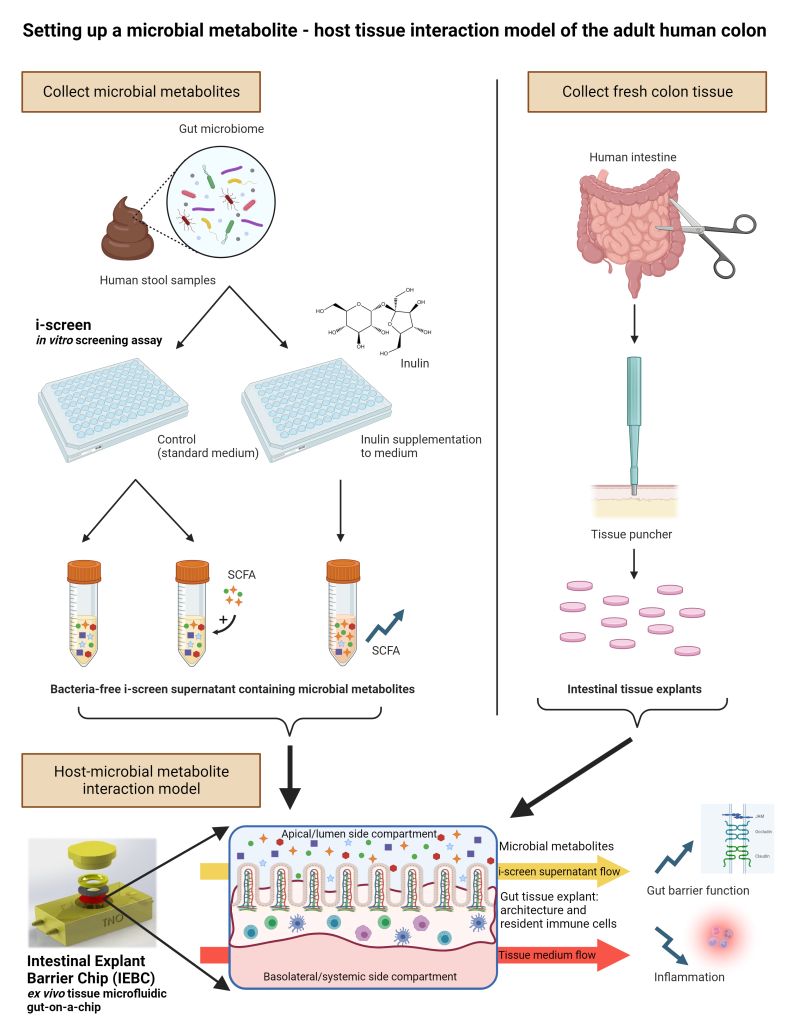
医薬品や栄養素の吸収、代謝、自然免疫系や微生物環境への影響を長時間にわたり検証することを可能とするGut-on-a-Chip。
個人間の変動を反映する多様な個人由来の腸組織やORGANOID、および腸内細菌叢を使用し、様々な疾患を標的にした個別化医療(Precision Medicine)を支援する Population-on-a-Chip の開発に取り組んでいます。
特徴
● 腸内の組織機能、局所炎症に対する宿主微生物の影響等を再現する高度な生理学的マイクロ流体デバイス(MPS)。
● ヒト腸組織の適用が可能。組織のViabilityとFunctionalityを24時間以上維持。
● 薬物や栄養素の自然免疫系への影響を検証可能
● ヒト腸内細菌叢との組み合わせで薬物吸収と免疫応答における宿主-微生物相互作用、親化合物のPhase-1、Phase-2代謝を検証可能。
技術資料ダウンロード:
●
Next Level Drug Research in an Ex vivo tissue Gut-on-a-Chip model: Advanced applications of the intestinal explant barrier chip. (Poster at #38JSSX, 2023)
●
A host-microbial metabolite interaction gut-on-a-chip model of the adult human intestine demonstrates beneficial effects upon inulin treatment of gut microbiome (Microbiome Research Report 2024 )
発表論文・Publication
Microbiome Research Report 2024
A host-microbial metabolite interaction gut-on-a-chip model of the adult human intestine demonstrates beneficial effects upon inulin treatment of gut microbiome
Joanne M. Donkers, Maria Wiese, Tim J. van den Broek, Esmee Wierenga, Valeria Agamennone, Frank Schuren and Evita van de Steeg.
The Royal Society of Chemistry 2021
Intestinal explant barrier chip: long-term intestinal absorption screening in a novel microphysiological system using tissue explants.
Hossein Eslami Amirabadi, Joanne M. Donkers, Esmee Wierenga, Bastiaan Ingenhut,c Lisanne Pieters, Lianne Stevens, Tim Donkers, Joost Westerhout, Rosalinde Masereeuw, Ivana Bobeldijk-Pastorova, Irene Nooijen and Evita van de Steeg
European Journal of Pharmaceutical Sciences 137 (2019) 104989
A higher throughput and physiologically relevant two-compartmental human ex vivo intestinal tissue system for studying gastrointestinal processes
Lianne J. Stevensa, Marola M.H. van Lipziga, Steven L.A. Erpelincka, Apollo Pronkb, Joost van Gorpb, Heleen M. Wortelboera, Evita van de Steeg.
Beneficial Microbes, 2019; 10(3): 225-236
Mechanisms and immunomodulatory properties of pre- and probiotics
V.B.M. Peters, E. van de Steeg, J. van Bilsen and M. Meijerink
Drug Metabolism and Disposition, Apr, 2017
Regional Expression Levels of Drug Transporters and Metabolizing Enzymes along the Pig and Human Intestinal Tract and Comparison with Caco-2 Cells
Stefan F.C. Vaessen, Marola M.H. van Lipzig, Raymond H.H. Pieters, Cyrille A.M. Krul, Heleen M. Wortelboer, and Evita van de Steeg
Journal of Nutritional Biochemistry 32 (2016) 142-150
Nutrient-induced glucagon like peptide-1 release is modulated by serotonin
Dina Ripkena, Nikkie van der Wielena, Heleen M. Wortelboer, Jocelijn Meijerinkc, Renger F. Witkamp, Henk F.J. Hendriks.
European Journal of Pharmaceutical Sciences 63 (2014) 167-177
A new approach to predict human intestinal absorption using porcine intestinal tissue and biorelevant matrices
Joost Westerhout, Evita van de Steeg, Dimitri Grossouw, Evelijn E. Zeijdner, Cyrille A.M. Krul, Miriam Verwei, Heleen M. Wortelboer

